カンカ主成分のエキナコシド、アクテオシド、およびイソアクテオシドの肝保護活性について、これら3成分はいずれも有意な肝障害抑制活性を有することが明らかになった。
近畿大学 薬学部・薬学総合研究所, 株式会社栄進商事
村岡 修, 李 征
ハマウツボ科植物カンカニクジュヨウ(Cistanche tubulosa (Schrenk)R. Wight )はベニヤナギの根部に寄生する植物で, 主に中国新彊ウイグル自治区やパキスタンなどの砂漠地帯に自生している植物である.主要産地であるタクラマカン砂漠南部に位置するホータンは世界有数の長寿地域として知られ, 現地では本植物の肉質茎を砂漠人参と称し, 昔から常食してきた.一方, 中国薬典では, カンカニクジュヨウと近縁種のニクジュウヨウ (C. salsa) はインポテンツ, 不妊, 腰痛, 虚弱体質の改善や血行促進を目的にひろく利用されているが, 砂漠の希少な植物であるニクジュヨウは近年, 採取が困難となっており同属のカンカニクジュヨウが代替植物として注目されている.著者らの研究室では, これまでにカンカニクジュヨウの含有成分として新規イリドイド配糖体 kankanosides A–E をはじめ, 9 種の新規化合物を単離・構造決定するとともに 30 種の既知成分を単離・同定し, さらに, 血管収縮抑制活性成分とその構造と活性の相関について明らかにした.1-2
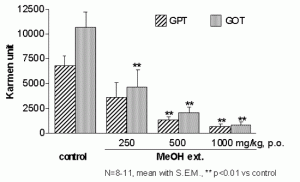
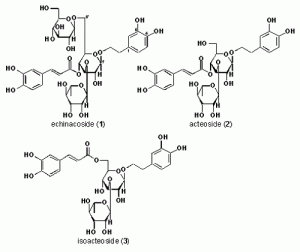
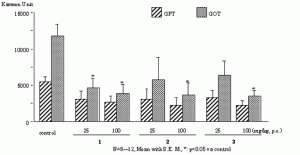
今回著者らは, カンカニクジュヨウの機能解明研究の一環として, カンカニクジュヨウの MeOH 抽出物 (250–1000 mg/kg, p.o.) が galactosamine (GalN)とlipopolysaccharide (LPS) により誘発されるマウス肝障害を用量依存的に有意に抑制することを見い出したことから, 肝障害抑制活性の作用機序と活性成分等を明らかにすることを目的に本研究を実施した(Fig. 1).先ず, カンカニクジュヨウの主成分として得られた echinacoside (1), acteoside (2) および isoacteoside (3) の肝保護活性について検討した.その結果, これら 3 成分はいずれも有意な肝障害抑制活性を有することが明らかになった (Fig. 2, 3).しかしながら, これら 3 成分の化学構造, 即ち, 6’位グルコースの有無, 4’位カフェイル基の結合位置の差異により肝障害抑制活性に明瞭な差異が観察されなかった事から, これらの作用点を明らかにする目的でin vitro試験での評価を行った.
本研究で使用している GlaN/LPS 誘発マウス肝障害の発症機序は, GalN 投与による肝臓でのガラクトース代謝系阻害による蛋白合成阻害とLPS投与による活性化マクロファージから放出される TNF-a などの炎症性サイトカインによる障害であることが知られている.そこで, LPS により誘発されるマクロファージの活性化に対する作用について LPS 刺激時におけるマクロファージからの NO 産生を指標に検討した.その結果, MeOH 抽出物および主成分 1–3 の内, MeOH 抽出物および 2 が高濃度でのみ有意な NO 産生抑制活性を示した (table 1).このことから, 肝保護活性の機序として LPS によるマクロファージ活性化に対する作用は弱いと考えられた.
Table 1 Effect on NO production in LPS-activated mouse peritoneal macrophages
|
Inhibition (%) |
|||
|
Conc. |
10 |
30 |
100 mM |
| echinacoside (1) | 3.9±1.8 | -2.6±1.5 | 14.9±5.5 |
| acteoside (2) | 9.7±1.1 | 4.1±5.5 | 27.7±2.3** |
| isoacteoside (3) | 1.1±2.8 | -0.6±2.4 | 16.5±2.5 |
N=4, Mean±S.E.M., **: p<0.01 vs. control
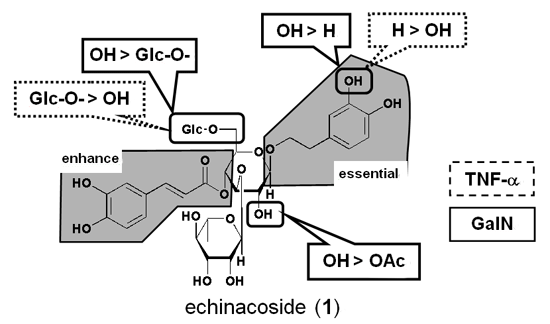
そこで, カンカニクジュヨウより得られた成分について GalN またはTNF-a により惹起される細胞障害に対する作用について検討した.その結果, 両障害に対し, フェニルエタノイド配糖体を中心に強い障害抑制活性を示す事が明らかになった (table 2).これらの結果から, GalN 誘発細胞障害抑制活性については, 1 の 6′ 位グルコースにより活性が減弱すること及び 1′ 位フェネチル基のカテコール構造により活性が上昇することを明らかにした.一方, TNF-a 誘発細胞障害に対しては, 逆に 1 の 6′ 位グルコースにより活性が増強すること及び 1′ 位フェネチル基のカテコール構造により減弱することを明らかにするとともに, 両障害に対しては 4′ 位カフェイル基の存在と結合位置が重要であること及び 1′ 位フェネチル基の存在が活性発現に必須な構造であることを明らかにした (Fig. 4).以上の結果から, GalN/LPS 誘発肝障害におけるカンカニクジュヨウの肝障害抑制活性成分の特徴は, LPS によるマクロファージ活性化に対する作用ではなく, GalN や TNF-α による細胞障害抑制が主たる機序であることが示唆された.
Table 2 Effects of constituents from C. tubulosa on GalN- or TNF-α-induced cytotoxicity
|
Inhibition (%) |
Inhibition (%) |
|||||
|
GalN |
TNF-a |
GalN |
TNF-a |
|||
| echinacoside (1) | 46.7±4.3** | 65.1±4.2** | 2′-acetylacteoside | 58.4±5.3** | 26.4±5.7* | |
| acteoside (2) | 71.8±2.3** | 34.3±5.3** | kankanoside G | 33.3±3.3** | 50.6±13.9** | |
| isoacteoside (3) | 57.3±2.2** | 22.4±5.3** | kankanose | -1.3±2.9 |
inactive |
|
| tubuloside A | 50.2±4.6** | 32.4±3.1** | cistanoside F | 4.0±2.6 | -1.2±8.6 | |
| tubuloside B | 33.6±4.5** | 52.0±5.4** | salidroside | 1.4±1.4 | 12.4±8.6 | |
N=4, Mean±S.E.M., *: p<0.05, **: p<0.01 vs. control
Sample Conc.: 10 and 30 mM against GalN and TNF-a respectively
参考文献
- Xie H., Morikawa T., Matsuda H., Nakamura S., Muraoka O., Yoshikawa M., Chem. Pharm. Bull., 54, 669—675 (2006).
- Yoshikawa M., Matsuda H., Morikawa T., Xie H., Nakamura S., Muraoka O., Bioorg. Med. Chem., 14, 7468—7475 (2006).